शालेय भौतिकशास्त्राच्या अभ्यासक्रमात इलेक्ट्रोलिसिस म्हणजे काय याचा प्रश्न विचारला जातो आणि बहुतेक लोकांसाठी हे रहस्य नाही. दुसरी गोष्ट म्हणजे त्याचे महत्त्व आणि व्यावहारिक उपयोग. ही प्रक्रिया विविध उद्योगांमध्ये मोठ्या फायद्यासह वापरली जाते आणि घरातील कारागीरांसाठी उपयुक्त ठरू शकते.
सामग्री
इलेक्ट्रोलिसिस म्हणजे काय?
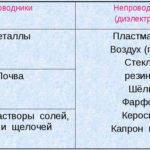
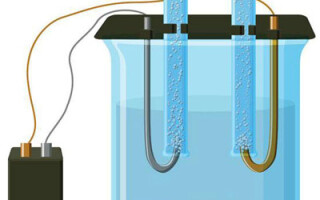
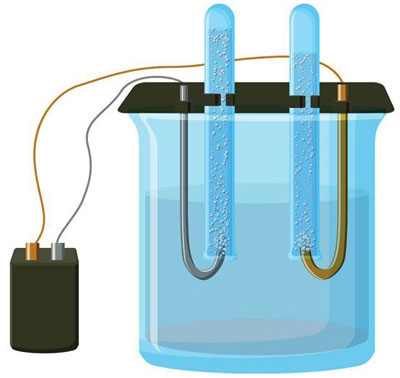
इलेक्ट्रोलिसिस हे इलेक्ट्रोड्स आणि इलेक्ट्रोलाइटच्या प्रणालीतील विशिष्ट प्रक्रियांचे एक जटिल आहे जेव्हा त्यातून थेट विद्युत प्रवाह वाहतो. त्याची यंत्रणा आयनिक प्रवाहाच्या घटनेवर आधारित आहे. इलेक्ट्रोलाइट एक प्रकार 2 कंडक्टर आहे (आयनिक चालकता) ज्यामध्ये इलेक्ट्रोलाइटिक पृथक्करण होते. हे सकारात्मक सह आयन मध्ये विघटनशी संबंधित आहे (cation) आणि नकारात्मक (anion) चार्ज.
इलेक्ट्रोलिसिस सिस्टममध्ये अपरिहार्यपणे सकारात्मक (एनोड) आणि नकारात्मक (कॅथोड) इलेक्ट्रोड. जेव्हा थेट विद्युत प्रवाह लागू केला जातो, तेव्हा केशन्स कॅथोडकडे आणि अॅनिऑन्स - एनोडकडे जाऊ लागतात. केशन्स हे प्रामुख्याने धातूचे आयन आणि हायड्रोजन असतात आणि आयन ऑक्सिजन, क्लोरीन असतात. कॅथोडवर, कॅशन्स स्वतःला अतिरिक्त इलेक्ट्रॉन जोडतात, ज्यामुळे घट प्रतिक्रिया Men+ + ne → मी (जेथे n ही धातूची व्हॅलेन्सी आहे). एनोडवर, उलटपक्षी, ऑक्सिडेटिव्ह रिअॅक्शनसह आयनॉनमधून इलेक्ट्रॉन दान केले जाते.
अशा प्रकारे, सिस्टममध्ये रेडॉक्स प्रक्रिया प्रदान केली जाते. हे लक्षात घेणे आवश्यक आहे की त्याच्या प्रवाहासाठी, योग्य ऊर्जा आवश्यक आहे. हे बाह्य वर्तमान स्त्रोताद्वारे प्रदान केले जाणे आवश्यक आहे.
इलेक्ट्रोलिसिसचे फॅराडेचे नियम
महान भौतिकशास्त्रज्ञ एम. फॅराडे यांनी त्यांच्या संशोधनामुळे केवळ इलेक्ट्रोलिसिसचे स्वरूप समजून घेणेच नव्हे तर त्याच्या अंमलबजावणीसाठी आवश्यक गणना करणे देखील शक्य केले. 1832 मध्ये, त्याचे कायदे दिसू लागले, जे चालू प्रक्रियेच्या मुख्य पॅरामीटर्सशी जोडले गेले.
पहिला कायदा
फॅराडेचा पहिला नियम सांगतो की एनोडवर कमी होत असलेल्या पदार्थाचे वस्तुमान इलेक्ट्रोलाइटमध्ये प्रेरित विद्युत शुल्काच्या थेट प्रमाणात असते: m = kq = k*I*t, जेथे q हा चार्ज आहे, k हा गुणांक किंवा इलेक्ट्रोकेमिकल समतुल्य आहे पदार्थाचा, I म्हणजे इलेक्ट्रोलाइटमधून वाहणार्या विद्युत् प्रवाहाची ताकद, टी म्हणजे वर्तमान उत्तीर्ण वेळ.

दुसरा कायदा
फॅराडेच्या दुसर्या कायद्याने समानुपातिकता k चे गुणांक निश्चित करणे शक्य केले. हे असे वाटते: कोणत्याही पदार्थाचे इलेक्ट्रोकेमिकल समतुल्य त्याच्या मोलर वस्तुमानाच्या थेट प्रमाणात आणि व्हॅलेन्सीच्या व्यस्त प्रमाणात असते. कायदा खालीलप्रमाणे व्यक्त केला जातो:

k = 1/F*A/z, जेथे F फॅराडे स्थिरांक आहे, A हे पदार्थाचे मोलर वस्तुमान आहे, z हे त्याचे रासायनिक व्हॅलेंसी आहे.
दोन्ही कायदे विचारात घेऊन, पदार्थाच्या इलेक्ट्रोडवर जमा केलेल्या वस्तुमानाची गणना करण्यासाठी अंतिम सूत्र प्राप्त करणे शक्य आहे: m = A*I*t/(n*F), जेथे n ही इलेक्ट्रोलिसिसमध्ये सामील असलेल्या इलेक्ट्रॉनची संख्या आहे. सहसा n आयनच्या चार्जशी संबंधित असतो. व्यावहारिक दृष्टीकोनातून, पदार्थाचे वस्तुमान आणि उपयोजित करंट यांच्यातील संबंध महत्त्वाचा असतो, ज्यामुळे त्याची ताकद बदलून प्रक्रिया नियंत्रित करणे शक्य होते.
वितळणे इलेक्ट्रोलिसिस
इलेक्ट्रोलिसिसच्या पर्यायांपैकी एक म्हणजे इलेक्ट्रोलाइट म्हणून मेल्टचा वापर. या प्रकरणात, केवळ वितळलेले आयन इलेक्ट्रोलिसिस प्रक्रियेत भाग घेतात. याचे उत्कृष्ट उदाहरण म्हणजे वितळलेल्या मीठाचे इलेक्ट्रोलिसिस NaCl (मीठ). नकारात्मक आयन एनोडकडे धावतात, याचा अर्थ वायू सोडला जातो (Cl). कॅथोडवर धातूची घट होईल, म्हणजे. जादा इलेक्ट्रॉन आकर्षित करणाऱ्या सकारात्मक आयनांपासून शुद्ध Na चे निक्षेपण. इतर धातू देखील अशाच प्रकारे मिळवता येतात (के, सीए, ली इ.) संबंधित क्षारांच्या हत्याकांडातून.
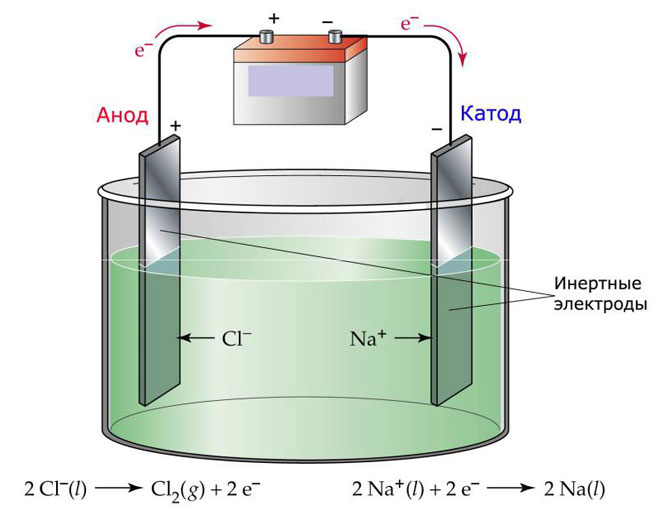
मेल्टमध्ये इलेक्ट्रोलिसिस दरम्यान, इलेक्ट्रोडचे विघटन होत नाही, परंतु केवळ वर्तमान स्त्रोत म्हणून भाग घेतात. त्यांच्या उत्पादनात, आपण धातू, ग्रेफाइट, काही अर्धसंवाहक वापरू शकता. सामग्रीमध्ये पुरेशी चालकता असणे महत्वाचे आहे. सर्वात सामान्य सामग्रीपैकी एक तांबे आहे.
सोल्यूशन्समध्ये इलेक्ट्रोलिसिसची वैशिष्ट्ये
जलीय द्रावणातील इलेक्ट्रोलिसिस वितळण्यापेक्षा लक्षणीय भिन्न आहे. येथे तीन स्पर्धात्मक प्रक्रिया घडतात: ऑक्सिजन उत्क्रांतीसह पाण्याचे ऑक्सीकरण, आयन ऑक्सिडेशन आणि धातूचे एनोडिक विघटन. पाण्याचे आयन, इलेक्ट्रोलाइट आणि एनोड प्रक्रियेत गुंतलेले असतात.त्यानुसार, कॅथोडमध्ये हायड्रोजन, इलेक्ट्रोलाइट केशन्स आणि एनोड धातूची घट होऊ शकते.

या स्पर्धात्मक प्रक्रिया होण्याची शक्यता प्रणालीच्या विद्युत क्षमतांच्या विशालतेवर अवलंबून असते. ज्या प्रक्रियेला कमी बाह्य उर्जेची आवश्यकता असते तीच प्रक्रिया पुढे जाईल. परिणामी, कॅथोडवर जास्तीत जास्त इलेक्ट्रोड संभाव्यतेसह केशन्स कमी केले जातील आणि सर्वात कमी क्षमता असलेल्या आयनांचे एनोडवर ऑक्सीकरण केले जाईल. हायड्रोजनची इलेक्ट्रोड क्षमता "0" म्हणून घेतली जाते. उदाहरणार्थ, पोटॅशियमसाठी ते आहे (-2.93V), सोडियम - (-2.71V), आघाडी (-0.13V), तर चांदीमध्ये (+0.8 व्ही).
वायूंमध्ये इलेक्ट्रोलिसिस
गॅस केवळ आयोनायझरच्या उपस्थितीत इलेक्ट्रोलाइटची भूमिका बजावू शकतो. या प्रकरणात, आयनीकृत माध्यमातून जाणारा विद्युत् प्रवाह इलेक्ट्रोड्सवर आवश्यक प्रक्रियेस कारणीभूत ठरतो. तथापि, फॅराडेचे नियम गॅस इलेक्ट्रोलिसिसवर लागू होत नाहीत. त्याच्या अंमलबजावणीसाठी, खालील अटी आवश्यक आहेत:
- वायूच्या कृत्रिम आयनीकरणाशिवाय, उच्च व्होल्टेज किंवा उच्च प्रवाह दोन्ही मदत करणार नाहीत.
- ज्या ऍसिडमध्ये ऑक्सिजन नसतो आणि ते वायूमय स्थितीत असतात आणि काही वायू इलेक्ट्रोलिसिससाठी योग्य असतात.
महत्वाचे! आवश्यक अटी पूर्ण झाल्यावर, प्रक्रिया द्रव इलेक्ट्रोलाइटमध्ये इलेक्ट्रोलिसिस प्रमाणेच पुढे जाते.
कॅथोड आणि एनोडवर होणार्या प्रक्रियेची वैशिष्ट्ये
इलेक्ट्रोलिसिसच्या व्यावहारिक वापरासाठी, जेव्हा विद्युत प्रवाह लागू केला जातो तेव्हा दोन्ही इलेक्ट्रोडवर काय होते हे समजून घेणे महत्त्वाचे आहे. वैशिष्ट्यपूर्ण प्रक्रिया आहेत:
- कॅथोड. सकारात्मक चार्ज केलेले आयन त्यावर गर्दी करतात. येथे, धातूंची घट किंवा हायड्रोजनची उत्क्रांती घडते. कॅशनिक क्रियाकलापानुसार धातूंच्या अनेक श्रेणी आहेत.Li, K, Ba, St, Ca, Na, Mg, Be, Al या धातूंचे प्रमाण केवळ वितळलेल्या क्षारांपासून चांगले कमी होते. जर द्रावण वापरले तर पाण्याच्या इलेक्ट्रोलिसिसमुळे हायड्रोजन सोडला जातो. द्रावणात कपात करणे शक्य आहे, परंतु कॅशनच्या पुरेशा एकाग्रतेसह, खालील धातूंसाठी - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Ag, Cu, Bi, Pt, Au, Hg साठी प्रक्रिया सर्वात सहजतेने पुढे जाते.
- एनोड. नकारात्मक चार्ज केलेले आयन या इलेक्ट्रोडमध्ये प्रवेश करतात. ऑक्सिडाइज्ड, ते धातूपासून इलेक्ट्रॉन घेतात, ज्यामुळे त्यांचे एनोडिक विघटन होते, म्हणजे. सकारात्मक चार्ज केलेल्या आयनमध्ये संक्रमण, जे कॅथोडला पाठवले जाते. Anions देखील त्यांच्या क्रियाकलाप त्यानुसार वर्गीकृत आहेत. अशा anions PO4, CO3, SO4, NO3, NO2, ClO4, F फक्त वितळण्यापासून सोडले जाऊ शकतात. जलीय द्रावणात ते इलेक्ट्रोलिसिस होत नाहीत, तर ऑक्सिजन सोडणारे पाणी असते. OH, Cl, I, S, B सारख्या anions सर्वात सहज प्रतिक्रिया देतात.

इलेक्ट्रोलिसिस सुनिश्चित करताना, इलेक्ट्रोड सामग्रीची ऑक्सिडाइझ करण्याची प्रवृत्ती विचारात घेणे आवश्यक आहे. या संदर्भात, निष्क्रिय आणि सक्रिय एनोड्स वेगळे आहेत. अक्रिय इलेक्ट्रोड हे ग्रेफाइट, कार्बन किंवा प्लॅटिनमचे बनलेले असतात आणि आयनच्या पुरवठ्यात भाग घेत नाहीत.
इलेक्ट्रोलिसिस प्रक्रियेवर परिणाम करणारे घटक
इलेक्ट्रोलिसिस प्रक्रिया खालील घटकांवर अवलंबून असते:
- इलेक्ट्रोलाइट रचना. विविध अशुद्धींचा लक्षणीय परिणाम होतो. ते 3 प्रकारांमध्ये विभागलेले आहेत - केशन, आयन आणि ऑर्गेनिक्स. पदार्थ बेस मेटलपेक्षा कमी किंवा जास्त नकारात्मक असू शकतात, जे प्रक्रियेत व्यत्यय आणतात. सेंद्रिय अशुद्धींमध्ये, प्रदूषक (उदा. तेल) आणि सर्फॅक्टंट्स वेगळे दिसतात. त्यांच्या एकाग्रतेमध्ये जास्तीत जास्त परवानगीयोग्य मूल्ये आहेत.
- वर्तमान घनता. फॅराडेच्या नियमांनुसार, जमा केलेल्या पदार्थाचे वस्तुमान वाढत्या वर्तमान शक्तीसह वाढते. तथापि, प्रतिकूल परिस्थिती उद्भवते - केंद्रित ध्रुवीकरण, वाढीव व्होल्टेज, इलेक्ट्रोलाइटचे तीव्र गरम. हे लक्षात घेऊन, प्रत्येक विशिष्ट केससाठी इष्टतम वर्तमान घनता मूल्ये आहेत.
- इलेक्ट्रोलाइट pH. वातावरणाची अम्लता देखील धातू लक्षात घेऊन निवडली जाते. उदाहरणार्थ, झिंकसाठी इलेक्ट्रोलाइट अम्लताचे इष्टतम मूल्य 140 g/cu.dm आहे.
- इलेक्ट्रोलाइट तापमान. त्याचा अस्पष्ट प्रभाव आहे. तापमानात वाढ झाल्याने, इलेक्ट्रोलिसिसचा दर वाढतो, परंतु अशुद्धतेची क्रिया देखील वाढते. प्रत्येक प्रक्रियेसाठी इष्टतम तापमान असते. सहसा ते 38-45 अंशांच्या श्रेणीत असते.
महत्वाचे! इलेक्ट्रोलिसिस विविध प्रभावांमुळे आणि इलेक्ट्रोलाइट रचनांच्या निवडीमुळे वेगवान किंवा कमी होऊ शकते. प्रत्येक अनुप्रयोगाची स्वतःची पथ्ये असते, जी काटेकोरपणे पाळली पाहिजे.
इलेक्ट्रोलिसिस कुठे वापरले जाते?
इलेक्ट्रोलिसिसचा वापर अनेक भागात केला जातो. व्यावहारिक परिणाम प्राप्त करण्यासाठी अनेक मुख्य क्षेत्रे आहेत.
इलेक्ट्रोप्लेटिंग
इलेक्ट्रोलिसिसद्वारे धातूची पातळ, टिकाऊ प्लेटिंग लागू केली जाऊ शकते. लेपित केलेले उत्पादन बाथमध्ये कॅथोडच्या स्वरूपात स्थापित केले जाते आणि इलेक्ट्रोलाइटमध्ये इच्छित धातूचे मीठ असते. म्हणून आपण जस्त, क्रोमियम किंवा कथील सह स्टील कव्हर करू शकता.

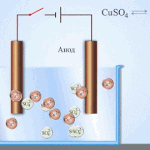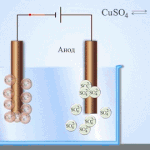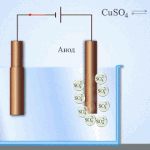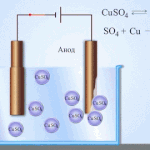
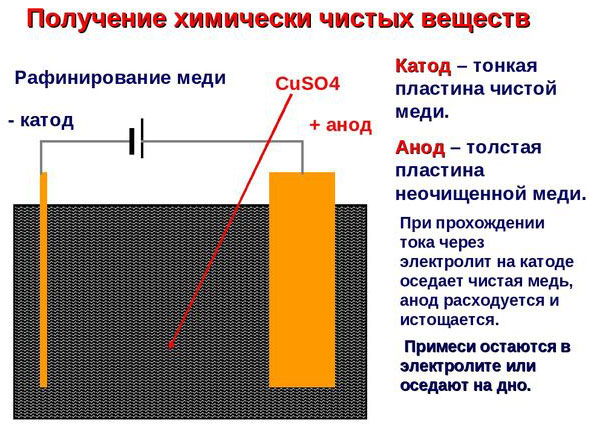
इलेक्ट्रोरिफायनिंग - तांबे शुद्धीकरण
विद्युत साफसफाईचे उदाहरण खालील पर्याय असू शकते: कॅथोड - शुद्ध तांबे एनोड - अशुद्धी असलेले तांबे, इलेक्ट्रोलाइट - तांबे सल्फेटचे जलीय द्रावण. एनोडमधून तांबे आयनमध्ये जातात आणि अशुद्धतेशिवाय कॅथोडमध्ये स्थिर होतात.
धातू खाण
क्षारांपासून धातू मिळविण्यासाठी, ते वितळण्यासाठी हस्तांतरित केले जातात आणि नंतर त्यामध्ये इलेक्ट्रोलिसिस प्रदान केले जाते. बॉक्साईट्स, सोडियम आणि पोटॅशियमपासून अॅल्युमिनियम मिळविण्यासाठी अशी पद्धत प्रभावी आहे.

Anodizing
या प्रक्रियेत, कोटिंग नॉन-मेटलिक संयुगांपासून बनविली जाते. एक उत्कृष्ट उदाहरण अॅल्युमिनियम अॅनोडायझिंग आहे. अॅल्युमिनियमचा भाग एनोड म्हणून स्थापित केला जातो. इलेक्ट्रोलाइट हे सल्फ्यूरिक ऍसिडचे द्रावण आहे. इलेक्ट्रोलिसिसच्या परिणामी, अॅल्युमिनियम ऑक्साईडचा एक थर एनोडवर जमा केला जातो, ज्यामध्ये संरक्षणात्मक आणि सजावटीचे गुणधर्म असतात. हे तंत्रज्ञान विविध उद्योगांमध्ये मोठ्या प्रमाणावर वापरले जाते. सुरक्षा नियमांचे पालन करून आपण आपल्या स्वत: च्या हातांनी प्रक्रिया पार पाडू शकता.
ऊर्जा खर्च
इलेक्ट्रोलिसिससाठी उच्च ऊर्जा खर्च आवश्यक आहे. जर एनोड करंट पुरेसा असेल तर ही प्रक्रिया व्यावहारिक मूल्याची असेल आणि त्यासाठी उर्जा स्त्रोताकडून महत्त्वपूर्ण थेट प्रवाह लागू करणे आवश्यक आहे. याव्यतिरिक्त, जेव्हा ते चालते तेव्हा साइड व्होल्टेजचे नुकसान होते - एनोड आणि कॅथोड ओव्हरव्होल्टेज, त्याच्या प्रतिकारामुळे इलेक्ट्रोलाइटमधील नुकसान. प्राप्त केलेल्या पदार्थाच्या उपयुक्त वस्तुमानाच्या युनिटशी ऊर्जा वापराच्या शक्तीशी संबंधित स्थापनेची कार्यक्षमता निर्धारित केली जाते.
इलेक्ट्रोलिसिसचा वापर उद्योगात बराच काळ आणि उच्च कार्यक्षमतेसह केला जात आहे. एनोडाइज्ड आणि इलेक्ट्रोप्लेटेड कोटिंग्स दैनंदिन जीवनात सामान्य बनले आहेत आणि सामग्रीचे खाणकाम आणि फायदा यामुळे धातूपासून अनेक धातू काढण्यास मदत होते. प्रक्रिया नियोजित आणि गणना केली जाऊ शकते, त्याचे मुख्य नमुने जाणून.
तत्सम लेख: